Contagem virtual de colônias
Content
Teste de suscetibilidade antimicrobiana
Existem métodos para testar a atividade antibacteriana de agentes antimicrobianos por muitas décadas. Normalmente, eles envolvem a exposição de bactérias ao agente antimicrobiano na presença de nutrientes que, de outra forma, permitiriam crescimento robusto das bactérias. As experiências poderiam ser realizadas em placas contendo ágar como suporte sólido ou em caldo líquido sem ágar. Muitos antibióticos de pequenas moléculas foram desenvolvidos usando esses métodos. No entanto, surgiu uma complicação quando os pesquisadores desejavam estudar a atividade antibacteriana de alguns peptídeos antimicrobianos, porque são inibidos por meios ricos, sejam fornecidos em uma placa de ágar ou em caldo. Por exemplo, as defensinas são peptídeos antimicrobianos que fazem parte do sistema imunológico inato de muitos organismos, incluindo humanos. Eles são divididos em várias classes estruturais, incluindo alfa, beta e teta, com base no padrão de ligação dissulfeto. Quatro defensinas alfa humanas são encontradas nos grânulos dos neutrófilos, e estes são conhecidos como peptídeos de neutrófilos humanos (HNP) 1-4. Muito cedo no estudo das defensinas, descobriu -se que os HNPs são fortemente inibidos pelas concentrações fisiológicas de sal. Para medir a atividade antimicrobiana dos HNPs, eles tiveram que ser incubados com células em um tampão de sal baixo como uma etapa inicial separada, antes de serem adicionados meios ricos, permitindo a enumeração de sobreviventes. Como não há como testar peptídeos como a defensina HNP1 na presença de concentrações de sal fisiologicamente relevantes, qualquer ensaio que mede a atividade do HNP1 usa condições diferentes das presentes no corpo.
Contagem tradicional de colônias
Um método comumente empregado para medir a atividade antimicrobiana no líquido é expor o agente antimicrobiano às células durante um tempo de incubação, como duas horas, e depois enumerar sobreviventes diluindo a mistura e depois espalhando uma parte do líquido em uma placa de ágar contendo mídia rica em mídia . A etapa de incubação é comumente feita em uma placa de 96 poços. Após a propagação, as placas de ágar são incubadas durante a noite e o número de unidades de formação de colônias (UFC) é contado no dia seguinte. Esses métodos têm várias desvantagens, incluindo a imprecisão introduzida na etapa de diluição e a possibilidade de que um grande número de placas de ágar fosse necessário para produzir um número aceitável de colônias por placa. Observe que, para medir a atividade antimicrobiana de agentes antimicrobianos, como defensinas, a etapa de incubação de duas horas seria realizada em um tampão de baixo sal, como o fosfato de sódio 10 mM, pH 7,4.
Concentração inibitória mínima
Outro método comumente empregado para medir a atividade antimicrobiana no líquido é expor a série de diluição do agente antimicrobiano a células em caldo rico, como o caldo Mueller-Hinton (MHB) em uma placa de 96 poços e depois incubar a placa de 96 poços em 37 ° C durante a noite. Cada poço se tornará turva com o crescimento bacteriano ou permanecerá claro. A concentração inibitória mínima (MIC) é então relatada como a menor concentração que produz um poço claro e, portanto, inibe o crescimento. Os métodos de MIC padronizados usando MHB não são aplicáveis a agentes antimicrobianos, como defensinas, porque as defensinas devem ser incubadas em um tampão de sal baixo, não em caldo rico, a fim de medir sua atividade.
Contagem virtual de colônias
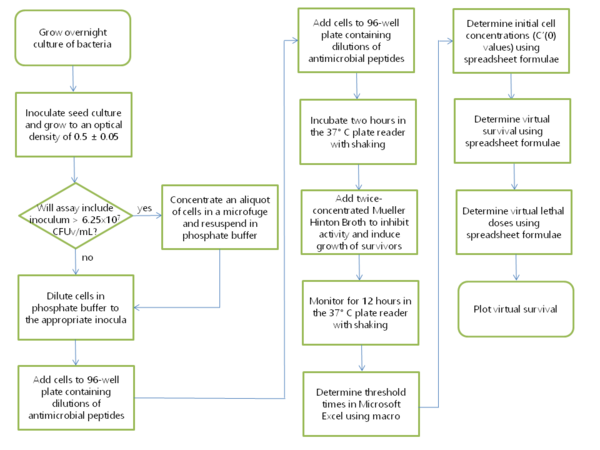
O método tradicional de contagem de colônias pode ser modificado para medir a atividade antimicrobiana na placa de 96 poços sem a necessidade de provar os poços e espalhar células sobreviventes nas placas de ágar, simplesmente adicionando um volume igual de caldo de duas vezes concentrado após a incubação de duas horas no The the baixo tampão de sal. Precisaria haver uma maneira de determinar quantas células sobreviveram no final do período de incubação usando culturas em lote. Felizmente, a matemática do crescimento exponencial oferece uma maneira de fazer exatamente isso. Se a turbidez, ou densidade óptica, das culturas de lote dentro da placa de 96 poços forem monitoradas em tempo real, e a quantidade de tempo necessária para que um poço atinja um limite seja registrada, e o tempo de duplicação das células de crescimento exponencial for Conhecido, então o número de células originalmente presente no inóculo pode ser calculado. Esse número inicial de células é igual ao número de células sobreviventes no final da incubação de duas horas com o agente antimicrobiano. Como esse procedimento não requer formação de colônias ou contagem de colônias reais, ele é denominado "contagem de colônias virtuais". Até agora, a técnica VCC foi limitada a peptídeos antimicrobianos. Poderia potencialmente trabalhar com outros agentes antimicrobianos, desde que o Mueller Hinton caldo de duas vezes concentre inativado a atividade antimicrobiana do agente. O método VCC pode detectar atividade bactericida ou bacteriostática, mas não pode distinguir entre eles. No entanto, a atividade bacteriostática pode ser quantificada medindo a diferença nos tempos limiares entre os controles de "entrada" e "saída" (veja abaixo).
Procedimento de laboratório geral para uso em ensaios de VCC

Uma cultura bacteriana de 2 ml é inoculada a partir de uma única colônia e crescida durante a noite em fosfato Mueller Hinton (PMH) ou mídia de fosfato Mueller Hinton Tryptic Soy (PMHT). PMH é uma mistura 1: 1 de caldo de Mueller Hinton e fosfato de sódio 10 mM pH 7,4. MHB ajustado por cátions ou não ajustado à cação pode ser usado. Em alguns experimentos, 1% de caldo de soja tríptico (TSB) estava presente no tampão fosfato para melhorar a atividade da defensina durante a incubação de duas horas; Nesse caso, a mistura análoga 1: 1 de tampão e caldo continha 0,5% de TSB e é chamada PMHT. 250 μL dessa cultura são transferidos para 25 mL de PMH em um frasco de filtro descartável de 125 mL. Essa cultura é cultivada a 37 ° C agitando 250 rpm, normalmente de 2 a 3 horas, até que a densidade óptica da cultura a 650 nm esteja entre 0,45 e 0,55. Enquanto isso, os peptídeos antimicrobianos são diluídos em uma placa de 96 poços (Costar 3595, que são tratados com a cultura do tecido) em fosfato de sódio 10 mM pH 7,4, de modo que o volume final seja 90 microlitros. As unidades de formação de colônias virtuais, ou CFUV, são definidas na publicação original do VCC e sua definição é repetida aqui: o CFUV foi mantido constante entre as seis cepas testadas para que a turbidez e, portanto, a quantidade de membrana celular, em cada experimento, foi aproximadamente igual . Como o CFUV foi padronizado para a UFC de Escherichia coli ATCC 25922, CFU, não CFUV, pode ser relatado com essa cepa. Para a porção experimental do ensaio, as células são diluídas em fosfato de sódio 10 mM pH 7,4, de modo que a concentração final de células em 10 microlitros seja de 5x106 CFUV/mL. 10 μl desta suspensão de células estão pipetados sob os 90 μl de peptídeos antimicrobianos em solução, resultando em uma suspensão de células no inóculo padrão de 5x105 CFUV/ml durante a exposição de células a peptídeos antimicrobianos. Vários poços da placa de 96 poços são usados para controles expostos a nenhum agente antimicrobiano; Estes são denominados controles de "saída". A placa de 96 poços foi incubada duas horas no leitor de placas, preparada para agitar e fazer leituras a cada cinco minutos. Durante esse tempo de incubação, a cultura de sementes foi mantida em gelo. Para uma curva de calibração, 1 mL de cultura de sementes foi adicionado a 1,5 mL de PMH após a incubação de duas horas para gerar uma suspensão de 108 CFUV/mL. Foi feita uma série de diluições de 10 vezes essa suspensão variando de 107 a 100 CFUV/mL em 200 μl de volume total de PMH, ocupando oito poços da placa de 96 poços. Nesse momento, as células expostas a nenhum agente antimicrobiano foram adicionadas a vários poços da placa da cultura mantidos no gelo; Eles são denominados controles de "entrada", pois indicam o número de células presentes no início da incubação de duas horas. Nos experimentos inicialmente publicados do VCC, apenas os 60 poços internos da placa foram utilizados, uma vez que a evaporação alterou o volume dos poços da borda durante a incubação de 12 horas. No entanto, todos os 96 poços da placa de 96 poços podem ser usados para o experimento, desde que a borda da placa seja embrulhada com um pedaço de parafilma M seis quadrados de comprimento por meio quadrado de largura. A parafilme permeável por gás retarda a evaporação, permitindo que a respiração celular e impedisse de partículas de serem sopradas na placa de 96 poços no leitor de placas. Depois que a placa é embrulhada com parafilme, ela é transferida do gabinete de biossegurança para o leitor de placas. Vários modelos de leitores de placas controlados por temperatura foram utilizados com sucesso em ensaios de VCC, incluindo um VMAX de dispositivos moleculares mantidos em uma sala quente, um espectramax de dispositivos moleculares e um Tecan Infinite M1000. O leitor de placas está configurado para ler a densidade óptica a 650 nm a cada 5 minutos por 12 horas, tremendo antes de cada leitura. Os dados brutos são importados para o Microsoft Excel, onde o Macro VCC calcula é executado para determinar o tempo necessário para cada curva de crescimento atingir uma densidade óptica limite de 0,02.
Cinética de crescimento quantitativo

O método de enumeração de células sobreviventes usadas pelo VCC é denominado cinética de crescimento quantitativo (QGK). Ele relaciona o tempo cinético gasto para a turbidez de uma cultura microbiológica em lote bacteriano em um poço de uma microplaca de 96 poços para atingir uma diferença limiar na turbidez a uma série de diluições de 10 vezes de curvas de crescimento de calibração.
A quantificação do número de células viáveis é feita usando um processo matematicamente idêntico à reação em cadeia da polimerase em tempo real quantitativa (qPCR), exceto com células QGK, em vez de cópias de produtos de PCR, crescem exponencialmente. O tempo necessário para atingir o limite é chamado de "tempo limite", TT, que é equivalente ao valor qPCR "tempo de ciclo" ou CT.
Existem pelo menos cinco processos que causam atrasos nos tempos limiares nos ensaios do VCC:
Adhesion, causing cells to stick to the microplate and possibly form biofilms. Unless these cells happen to be directly in the light path, their growth will not affect optical density readings.Cohesion, causing cells to aggregate into clumps of various sizes instead of a homogeneous suspension of individual cells undergoing binary fission. Cohesion can cause imprecision and fluctuations in Tt. Cohesive clumps may also be adhesive, leading to both imprecision due to cohesion and inaccuracy (increased Tt) due to adhesion.Bacteriostatic activity, causing cells to become unable to enter exponential growth even though they are not killed. Transient bacteriostatic activity can cause lag times, increasing Tt.The metabolic lag phase of bacterial growth. Such a lag phase would be expected to occur in the assay as cells growing slowly or not at all during the initial exposure to antimicrobial peptides in the low-salt buffer are shifted to exponential growth upon addition of twice-concentrated rich media. If this metabolic lag phase increases in the presence of the antimicrobial peptide, it could be considered a form of transient bacteriostatic activity in category 3, above, although other sources of transient bacteriostatic activity, such as a delay due to the time required for the repair of damaged cell structures such as cell walls or cell membranes, are possible.Bactericidal activity, or killing. Fewer surviving cells cause a delay in Tt as the survivors take longer to produce the same amount of turbidity through exponential growth. If all other processes causing increases in Tt are negligible, the VCC assay becomes a bactericidal assay and Tt can be used to enumerate viable bacteria by QGK. In this simplified case, VCC "virtual survival" results are equivalent to the "survival" results of a traditional colony count bactericidal assay.Bactérias
O VCC foi inicialmente empregado para quantificar a atividade antibacteriana dos peptídeos contra seis cepas de Escherichia coli, Staphylococcus aureus, Bacillus cereus e Enterobacter Aerogenes. Geralmente, é comparada uma cepa de controle de qualidade gram-negativa e gram-positiva padrão. Escherichia coli ATCC 25922 e Staphylococcus aureus ATCC 29213 foram usados como cepas gram-negativas e gram-positivas padrão, respectivamente. O VCC também foi aplicado a Bacillus Anthracis, o agente causador do antraz. Além disso, o VCC foi aplicado a Salmonella enterica serovar Typhimurium e Acinetobacter Baumannii.
Peptídeos antimicrobianos
O estudo inicial da contagem de colônias virtuais mediu a atividade de todas as seis defensinas alfa humanas simultaneamente na mesma placa de 96 poços: HNP1, HNP2, HNP3, HNP4, HD5 e HD6. Posteriormente, formas mutadas de algumas dessas seis defensinas foram estudadas pelo VCC. Uma glicina conservada em uma protuberância beta no HNP2 foi substituída por uma série de aminoácidos D, resultando na atividade do VCC proporcional à hidrofobicidade e carga da cadeia lateral. O VCC mostrou que a atividade de HNP2 acetilada e/ou terminal de N-terminal é proporcional à carga eletrostática. Os resultados do VCC foram novamente proporcionais à carga de uma série de mutantes que desreram a ponte de sal, sugerindo que a ponte de sal não é necessária para a função HNP2. O VCC mediu a importância dos segmentos profissionais naturais e artificiais do N-terminal do proptídeo HNP1, alterando dramaticamente a atividade contra Escherichia coli e Staphylococcus aureus. As formas enantiômero de HNP1, HNP4, HD5 e beta-defensina 2 compostas inteiramente de d-aminoácidos sugeriram mecanismos diferentes de atividade de defensina contra bactérias gram-positivas e gram-negativas. Os resultados do VCC de monômero com deficiência de dimerização e formas de dímero amarrado de HNP1 demonstraram a importância da dimerização. A substituição da glicina conservada por L-alanina resultou em diferenças sutis do VCC. A mutagênese abrangente de varredura de alanina de HNP1 e HD5 demonstrou a importância de resíduos hidrofóbicos volumosos. A redução de dissulfeto de HD5 prejudicou a atividade do VCC, mas aumentou a atividade de ligação a lipopolissacarídeos contra três cepas gramaticais. As variantes do HD5 com uma ligação dissulfeto ou nenhuma ligação dissulfeto exibiram bastante atividade de VCC contra A. baumannii, enquanto um derivado simplificado da HD5 construído por redução de dissulfeto e introdução de arginina exibiu atividade potente contra uma linhagem resistente a multidrug de A. baumannii. Esses estudos foram expandidos para incluir defensinas beta adicionais, defensinas teta e a catelicidina humana LL-37 e peptídeos relacionados.
Efeito inóculo
Um efeito inóculo foi descrito anteriormente para muitos agentes antimicrobianos, de modo que o agente é menos eficaz quando mais bactérias são adicionadas ao ensaio. Esse efeito é frequentemente observado com as lactâmicas beta quando analisado contra bactérias que produzem beta -lactamase. O efeito inóculo foi potencialmente relevante para um estudo de HNP1, Pro LL-37 e LL-37, que incluía contagem tradicional de colônias e VCC lado a lado. Nesse relatório, verificou -se que os valores tradicionais de sobrevivência da contagem de colônias eram menores que os valores de sobrevivência virtual para todos os peptídeos e cepas testadas. Como o inóculo de bactérias foi 20 vezes maior no ensaio VCC em comparação com o protocolo tradicional de contagem de colônias padronizado usado, a diferença poderia ter sido devido a um efeito inóculo, embora o efeito tenha sido o inverso do efeito inóculo normalmente visto com Outros agentes antimicrobianos, uma vez que o inóculo mais alto mostrou mais atividade. Essa possibilidade foi investigada em uma série de experimentos com VCC, focando principalmente na defensina HNP1 e nas cepas bacterianas E. coli, S. aureus e B. cereus. Os resultados de seis experimentos demonstraram um efeito de inóculo pronunciado do HNP1 contra E. coli.
Algoritmos para analisar a cinética de crescimento quantitativo
As planilhas complexas do Microsoft Excel usadas para o cálculo de sobrevivência virtual e valores de dose letal virtual, e uma macro Visual Basic usada para calcular os tempos de limite, foram publicados.
Técnica de pipetagem segura e eficaz
Os usuários do VCC são advertidos para transferir células em um pequeno volume, como 10 microlitros abaixo de um volume maior, como 90 microlitros, semelhantes às curvas de calibração QGK mostradas acima e as curvas de calibração relatadas na publicação inicial do VCC, mas, diferentemente do procedimento experimental usado para Teste a atividade da defensina no mesmo artigo. A técnica aprimorada de pipetagem foi descrita em 2011 no estudo do patógeno Anthracis de Biossegurança Nível 3 (BSL-3). O método original publicado em 2005 envolveu a transferência de 50 microlitros de suspensões celulares para 50 microlitros de líquido, que gera espuma, bolhas e turbidez incompatíveis com um método turbidimétrico quando as células são transferidas diretamente para o fundo dos poços abaixo do tampão de fosfato soluções. Evitar esse problema adicionando suspensões de células como gotículas acima podem causar aerossóis que resultam em contaminação cruzada. Os bioaerossóis de bactérias perigosas também podem representar riscos de segurança que podem ser reduzidos através da realização de experimentos em um gabinete de biossegurança.






